 |
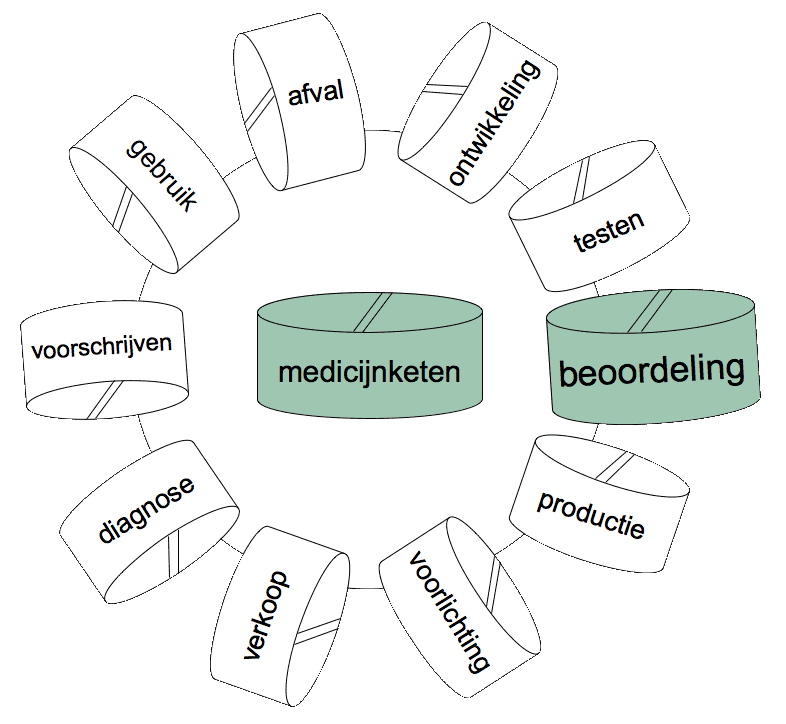
Een maatschappelijk verantwoorde medicijnbeoordeling ten behoeve van haar registratie, bestrijkt de hele levenscyclus van een middel. Daarbij hoort, naast de standaardcriteria als effectiviteit, ook de kringloop van het medicijn en de biologisch actieve omzettingsproducten via drinkwater, lucht en voeding. Ook aspecten als resistentievorming, -versterking en - verspreiding. Deze indirecte risico’s van medicijnen voor de volksgezondheid worden momenteel niet meegewogen in de toelating van medicijnen 1). Daarnaast is een beoordeling van de sociaal-economische en ecologische effecten van de productie en grondstofwinning gewenst. |