 |
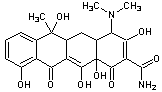
Het tetracyclinemolecuul bestaat uit vier verbonden koolstofringen (de hydronaftaceenkern), waaronder één benzeenring. De basisformule van tetracycline is C22H24N2O8. De verschillen tussen de verschillende soorten tetracyxlinen bestaan uit de aanhechting van H, OH, CHn, Cl of N(CH3)2 groepen. Door aanhechting van deze groepen zijn tetracyclinen meer vetminnend (lipofiel), en daarmee meer biologisch actief geworden, dan de oorspronkelijke tetracycline. |
1) Halling-Sørensen et al 2002b in 9).
2) o.a. Brody, TM, J Larner, KP Minneman, 1998, Human Pharmacology, Mosby Missouri
3) Oka et al 2000 in 9).
4) De octanol-water verdelingscoëfficient (Log Kow) van tetracyclinen ligt tussen de 1,3 en 0,05.
5) Volgens diverse bronnen in 9) ligt de wateroplosbaarheid tussen de 230 mg/L en 52 g/L.
6) Brody, TM, J Larner, KP Minneman, 1998, Human Pharmacology, Mosby Missouri
7) Ciancio, G en PC Bourgault, 1989, Clinical Pharmacology for dental professionals, Year Book Medical Publishers Inc. Chicago.
8) Mitscher 1978 in 9)
9) Thiele-Bruhn S, 2003, Pharmaceutical antibiotic compounds in soils- a review, J. Plant Nutr. Soil Sci. 166, 145-167.