A. Swedish Environmental Classification and Information System for pharmaceuticals, SECIS
SECIS is van oorsprong een initiatief uit het jaar 2003 van de Stockholm County Council en Zweedse apothekersorganisatie. In het jaar 2005 is het model vrijwillig geadopteerd door een coalitie van alle (>60) farmaceutische industrieën vertegenwoordigd in Zweden 1), ondermeer met het doel de controle te behouden 2). In 2007 en 2008 wordt door overheden in Duitsland en Nederland overwogen dit model op EU-schaal over te nemen 3).
Tot februari 2010 werden voor de SECIS database zowel de PBT- als de PEC/PNEC-scores voor meer dan 691 medicijnen verwerkt 4). Voor 281 middelen (41%) kon classificatie niet worden uitgevoerd wegens gebrek aan toxiciteits- en andere gegevens. 217 middelen (zoals vitaminen en vaccins) vielen buiten de classificatie. 193 middelen konden wel geclassificeerd worden: 168 middelen werden geclassificeerd met een niet significant milieurisico, 16 met een laag, 7 met een gemiddeld (allopurinol, amoxicilline, mykofenolatmofetil, natriummykofenolat, propanolol, raloxifene en sertraline), en 2 met een groot milieurisico (estradiol en ethinylestradiol). Tot zover bekend bezitten 63 middelen de potentie zich in waterorganismen op te hopen 5).
In 2008 is SECIS-database door Stichting Huize Aarde en de Universiteit Twente geëvalueerd 6). In 2008 - 2009 is door de universiteit van Stockholm een grondige evaluatie van het model uitgevoerd 7).
Evaluatie van SECIS door Stichting Huize Aarde en Universiteit Twente
De SECIS-methodiek (voorheen het Stockholm-model genoemd) blijkt een groot aantal beperkingen te hebben. De gegevens die voor deze classificatie worden gebruikt zijn deels gebaseerd op niet publieke bronnen van de farmaceutische industrie. Ook zijn de gebruikte toxiciteitgegevens voornamelijk gebaseerd op onderzoek naar acute toxiciteit in hoge, niet milieurelevante, concentraties (in milligrammen per liter), terwijl acute ecotoxicologie volgens wetenschappers niet als een meetinstrument voor risicobepaling gebruikt zou moeten worden 8). Weinig gebruik wordt gemaakt van publiekelijk beschikbare gegevens over chronische toxiciteit aan lage, meer milieurealistische, concentraties (micro- en nanogrammen/L). Bijvoorbeeld, SECIS gaat uit van de acute toxiciteit van diclofenac tussen 10 en 100 milligram/L (mg/L). De chronische toxiciteit van diclofenac ligt in de literatuur op dat moment echter tussen de 1 en 10 microgram/L (µg/L) 9). Dit voorbeeld laat zien dat chronische toxiciteit wel een factor 10.000 hoger kan liggen dan de acute toxiciteit. In SECIS wordt voor de verwerking van gegevens over acute giftigheid in de PEC/PNEC-score slechts een veiligheidsmarge van 1000 toegepast.
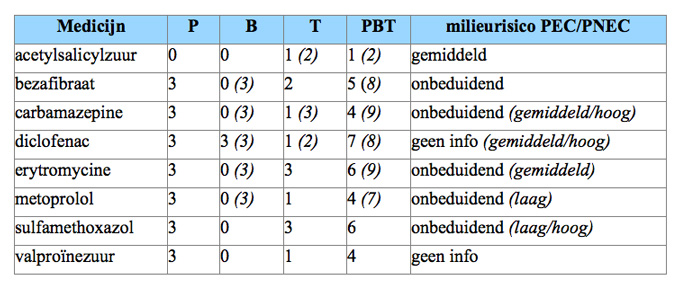
Wanneer chronische toxiciteitgegevens in SECIS zouden worden gebruikt, veranderen de T- en daarmee de PBT-scores voor carbamazepine, erytromycine, metoprolol en bezafibraat aanzienlijk, zie tabel. Hetzelfde geldt voor vaststelling van PEC/PNEC-score. In SECIS worden de No Effect-waarden gebaseerd op de grove acute toxiciteitscore. Hierdoor wordt door SECIS het milieurisico voor vrijwel alle medicijnen als “onbeduidend” beoordeeld. Wanneer gegevens uit chronisch onderzoek met milieurelevante concentraties zou worden gebruikt, veranderen ook de PEC/PNEC-scores. In tabel 2 is dit voor vijf in het oppervlaktewater vaak voorkomende medicijnen gedemonstreerd. De meer realistische PEC/PNEC-waarden (in de tabel tussen haakjes gezet) liggen telkens één tot drie risicoklassen hoger.
Tabel PBT- en PEC/PNEC-scoren van enkele medicijnen volgens SECIS
(opname 10-1-2009) en op basis van chronische ecotoxicologie
Chronisch ecotoxicologische gegevens zijn tussen haakjes gezet: B(erytromycine, atorvastatine en bezafibraat) naar EMEA in Ternes and Joss 2006 10); B(diclofenac in vis) naar Schwaiger et al 2004 11); B(metoprolol in mosselen) naar Contardo-Jara et al 2010 12); B(carbamazepine in kreeftachtigen) naar Vernouillet et al 2010 13); T(n) naar Fent, 2005 14); PEC/PNEC(n) naar Rademaker en De Lange, 2008 15).
In de SECIS-database is de uiteindelijke waarde van de PBT-score niet helder. Wegens de continue aanvoer van medicijnen naar het milieu, zijn persistentie en bioaccumulatie minder van belang dan toxiciteit. Door een gelijk gewicht toe te kennen aan elke parameter P, B en T, kan de belangrijkste parameter, toxiciteit, ondergewaardeerd worden. De P-scores (afbraak > 60% in 28 dagen = 0; en afbraak ≤ 60% in 28 dagen = 3) en de B-scores (wel bioaccumulatie = 3, geen bioaccumulatie = 0;) zijn tamelijk grof. Hierdoor kunnen deze scores sterk veranderen bij iets andere oorspronkelijke waarden. Daarnaast worden de toxiciteitscores van het model uitsluitend gebaseerd op overlijden bij milieu-irrelevante concentraties (de Letale Concentratie waarbij de helft van de proefpopulatie sterft, de LC50 < 1mg/L = 3, en tussen 1-10 mg/L = 2, en tussen > 10-100 mg/L = 1). Om een juist beeld te geven van de effecten van een chronische blootstelling aan verschillende medicijnen dienen daarentegen vooral effecten op het niveau van gedrag, ontwikkeling, voortplanting, gezondheid e.d. geëvalueerd te worden.
Voor de PBT- en PEC/PNEC-meetinstrumenten zouden op internationale schaal standaardmethoden vastgesteld dienen te worden 16). Het beheer van de database zal op basis van realistische milieugegevens plaats moeten vinden.
Evaluatie van SECIS door de universiteit in Stockholm
Onderzoekers van de universiteit in Stockholm hebben de SECIS-resultaten vergeleken met publieke data, wat voor 10 middelen in een hogere risicoklasse en voor 3 middelen in een lagere risicoklasse resulteerde. Ook vond men voor dezelfde middelen verschillende interpretaties van de P, B en T- en PEC/PNEC-scoren door verschillende farmaceutische bedrijven. Zo schalen verschillende bedrijven het milieurisico van estradiol zowel niet significant, gemiddeld, als hoog in. Uit een steekproef van 27 middelen bleek bij 19 middelen (70% van de gevallen) discrepantie te bestaan tussen verschillende bronnen.
Volgens de auteurs is risicoclassificatie evenwel een dynamisch proces, dat, mede gezien de grote kennislacunes, onder snelle verandering onderhevig is. Dit verklaart een deel van discrepanties 17). Gezien het grote verschil in vele mogelijke aangrijpingspunten (end points) en milieuomstandigheden komen daarnaast in toenemende mate nieuwe, meer gevoelige, niet-standaard testresultaten beschikbaar, wat onderlinge vergelijking verder zal bemoeilijken 18).
Voor de auteurs was het niet duidelijk wie gebruik van SEGIS-classificatie maakt en of het haar doel dient. Naast dat veel toxiciteitsgegevens ontbreken, waardoor geen afdoende classificatie gemaakt kan worden, is het vergelijken van de milieuscore van verschillende medicijnen met dezelfde therapeutische functie in SEGIS gecompliceerd. Dit belemmert een eventuele vervanging van meer door minder milieubelastende middelen. Deze onvolkomenheden zijn volgens de auteurs waarschijnlijk het gevolg van het feit dat meerdere farmaceuten bij het model zijn betrokken, waardoor geen voorkeur voor bepaalde middelen uitgesproken kan worden. Aanbevolen wordt het beheer van de database door een onafhankelijk orgaan uit te laten voeren 19). Ook beperkt de Zweedse taal van de database bredere toepassing 20).
Om wille van meer transparantie heeft de universiteit van Stockholm in 2008 een vrij toegankelijke database met ecotoxiciteitgegevens uit het publieke wetenschappelijke domein opgezet 21), zie www.WikiPharma.org. Halverwege 2009 bevat deze database acute en chronische toxiciteitsdata van 831 verschillende actieve ingrediënten, waaronder enkele omzettingsproducten, bij 127 verschillende (water)organismen. Voor 116 van deze middelen zijn acute (ong. 55%) en/of chronische (ong. 45%) effecten gevonden, met testconcentraties die veelal ver boven de milieuconcentraties liggen. Het wachten is op onderzoek naar reële milieurisico’s, die afhankelijk zijn van lokale concentraties en gebruikscijfers.
> naar evaluatie GWRC-classificatie
1) Zie www.fass.se
2) Ågerstrand M et al 2009, The Swedish Environmental Classification and Information System for Pharmaceuticals — An empirical investigation of the motivations, intentions and expectations underlying its development and implementation, Environment International 35: 778–786.
3) Kamerbrief 2007; en mondelinge mededeling door Åke Wennmalm, Stockholm City Council, 2008.
4) Zie www.fass.se
5) Ågestrand and Rudén 2010, Evaluation of the accuracy and consistency of the Swedish Environmental Classification and Information System for pharmaceuticals, Science of the Total Environment 408:2327–2339
6) Verstraaten M F 2008, Gezond watermilieu - het voorkomen en de risico’s van medicijnen in het watermilieu en mogelijk te nemen maatregelen, Masterthesis, Universiteit Twente.
7) Ågerstrand M et al 2009; Ågerstrand M and Ch Rudén 2010.
8) Halling-Sørensen et al 1998, Occurense, fate and effects of pharmaceutical substances in the environment - a review, Chemosphere 36(2):357-393.
9) Fent K et al 2005, Ecotoxicology of Human Pharmaceuticals, Review, Aquatic Toxicology (76) 2006 122-159.
10) Ternes and Joss 2006, Human pharmaceuticals, hormones and fragances - the challange of micropollutants in urban water management, IWA Publishing
11) Schwaiger J et al 2004, Toxic effects of the non-steroidal anti-inflammatory drug diclofenac. Part I: histopathological alterations and bioaccumulation in rainbow trout. Aquat Toxicol 68:141–150.
12) Contardo-Jara V et al 2010, The b-receptor blocker metoprolol alters detoxification processes in the non-target organism Dreissena polymorpha, Environmental Pollution 158:2059-2066.
13) Vernouillet G et al 2010, Toxic effects and bioaccumulation of carbamazepine evaluated by biomarkers measured in organisms of different trophic levels, Chemosphere 80(9):1062-1086.
14) Fent et al 2005
15) Gebruikmakend van bronnen uit Rademaker W en M de Lange, 2009, De risico’s van geneesmiddelen in het aquatisch milieu, H2O (5):29-32.
16) Ågerstrand et al 2011, Reporting and evaluation criteria as means towards a transparent use of ecotoxicity data for environmental risk assessment of pharmaceuticals, Environmental Pollution xx:1-6
17) Ågersrand M and Ch Rudén 2010.
18) Ågerstrand et al 2011, Comparison of four different methods for reliability evaluation of ecotoxicity data: a case study of non-standard test data used in environmental risk assessments of pharmaceutical substances, Environmental Sciences Europe, 23:17.
19) Ågerstrand et al 2009.
20) Ågersrand M and Ch Rudén 2010.
21) Molander L et al 2009, WikiPharma – A freely available, easily accessible, interactive and comprehensive database for environmental effect data for pharmaceuticals, Regulatory Toxicology and Pharmacology 55 (2009) 367–371.